26/04/2021 - 23:08
Por Ricardo Brito
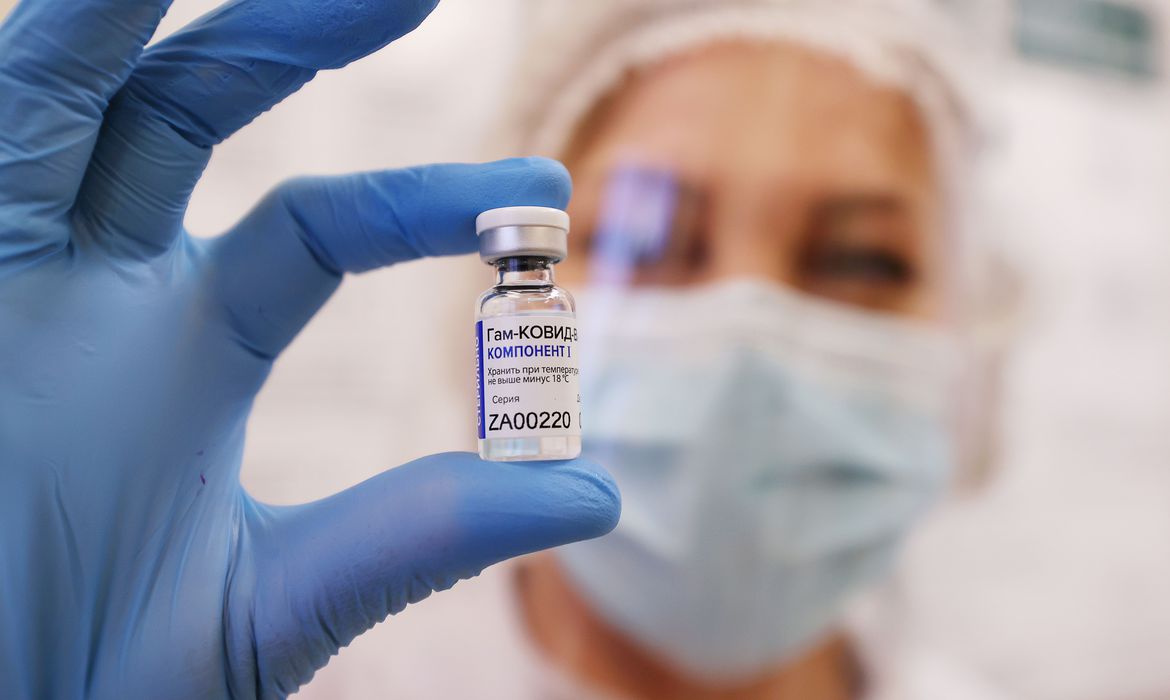
BRASÍLIA (Reuters) – A Agência Nacional de Vigilância Sanitária (Anvisa) decidiu nesta segunda-feira rejeitar, por unanimidade, pedido de autorização feito por governos estaduais para importação da vacina russa contra a Covid-19 Sputnik V, alegando falta de informações suficientes para garantir a segurança, a qualidade e a eficácia do imunizante.
Relator do pedido, o diretor Alex Machado Campos disse que o órgão regulador tentou obter, sem sucesso, dados técnicos para fazer uma avaliação do pedido de importação, inclusive com o envio de uma equipe técnica à Rússia com esse objetivo, mas que não obteve os acessos necessários.
+ Vacinados com a 1ª dose contra covid chegam a 29,5 milhões; 13,96% da população
“Para a vacina Sputnik V, foram observadas falhas de desenvolvimento do produto, vou repetir, foram observadas falhas no desenvolvimento do produto que resultam incertas quanto à qualidade, segurança e eficácia da vacina assim como também foram verificados que os controles de qualidade implementados são insuficientes, seja em relação ao produto ou em relação ao processo”, disse o relator em reunião da Anvisa para decidir sobre o pedido de importação.
A diretoria da Anvisa seguiu por 5 votos a 0 a recomendação da área técnica da agência reguladora, que listou uma série de “deficiências” no pedido de importação. Entre um dos principais pontos observados pela área técnica foi verificada a possibilidade de replicação do adenovírus utilizado para levar o material genético do coronavírus para o corpo — o contrário do efeito que se pretende com a imunização.
“Como o desenvolvimento não foi conduzido de forma a garantir a não-replicação do vírus, vírus que replicam, não desejados, estão presentes na vacina. Portanto, a vacina não cumpre o próprio critério estabelecido para o seu desenvolvimento”, acrescentou o relator na reunião, que levou mais de cinco horas de duração e acabou tarde da noite.
A Sputnik foi aprovada em diversos países pelo mundo, incluindo a Argentina. Os criadores do imunizante concluíram que a vacina tem eficácia de 97,6% contra a Covid-19 no “mundo real”, de acordo com uma avaliação de dados de 3,8 milhões de pessoas, anunciaram o Instituto Gamaleya de Moscou e o Fundo de Investimentos Diretos da Rússia (RDIF) na semana passada.
Mas, assim como a Anvisa, a União Europeia também ainda não aprovou a vacina enquanto aguarda mais informações sobre os testes e o processo de fabricação.
O diretor presidente da Anvisa, Antonio Barra Torres, disse que não é possível comprovar essa eficácia sem a divulgação dos dados completos, e citou que a delegação da agência enviada a Moscou não recebeu autorização para inspecionar o Instituto Gamaleya.
O pedido de autorização para importação para o Brasil foi apresentado por governos estaduais que pressionam pela aprovação da Sputnik V para tentar avançar com a vacinação contra Covid-19, uma vez que a campanha coordenada pelo governo federal sofre com uma escassez de imunizantes.
A Anvisa marcou a reunião para esta segunda após uma decisão do ministro Ricardo Lewandowski, do Supremo Tribunal Federal (STF), que estabeleceu 30 dias para que o órgão avaliasse os pedidos de importação de vacinas para Covid sem registro no país.
O Brasil conta até o momento com duas vacinas contra a Covid-19, a CoronaVac, envasada pelo Instituto Butantan, e Oxford/AstraZeneca, envasada pela Fundação Oswaldo Cruz (Fiocruz). Uma terceira vacina, da Pfizer/BioNTech, será aplicada a partir de maio na população.
No fim de semana, o Ministério da Saúde divulgou uma nova versão do cronograma de recebimento de vacinas com uma redução de 30% no quantitativo de doses previstas para maio, de 46,9 milhões para 32,4 milhões, devido à retirada de imunizantes previstos, mas que não foram aprovadas pela Anvisa, como a Sputnik V.
Até o momento, o país vacinou 27,3 milhões de pessoas com a primeira dose, o equivalente a 13% da população, de acordo com dados do Ministério da Saúde.